Ácidos oxácidos
Los ácidos oxácidos u oxoácidos son compuestos ternarios formados por un óxido no metálico y una molécula de agua (H2O).
Su fórmula responde al patrón HaAbOc, donde A es un no metal o metal de transición.
Ejemplos:
- Ácido sulfúrico (H2SO4). Formado por la combinación de una molécula de H2O con una molécula de óxido sulfúrico SO3:
SO3 + H2O → H2SO4
- Ácido sulfuroso (H2SO3). Formado por la combinación de una molécula de H2O con una molécula de óxido sulfuroso SO2:
SO2 + H2O → H2SO3
- Ácido hiposulfuroso (H2SO2). Formado por la combinación de una molécula de H2O con una molécula de óxido hiposulfuroso SO:
SO + H2O → H2SO2
Nomenclatura
Tradicional
Aceptada por la IUPAC, es la forma más usual de escribir los nombres de estos compuestos. Se escribe Anhídrido + agua. Ej.:
- Ácido crómico: CrO3 + H2O → H2CrO4
Atajos para:
- Conseguir la valencia del no metal: [(subíndice del oxígeno x2)-(subíndice del hidrógeno)]/(subíndice del no metal) (ej: H2CrO4 → 4·2-2·1=6). Este método es una abreviatura de aplicar el álgebra para resultado carga 0
- Detectar casos piro y orto para fórmulas directas:
- Valencia impar (el no-metal tiene estado de oxidación +1,+3,+5,+7):
- Piro: H4A2
- Orto: H3A
- Valencia par (el no-metal tiene estado de oxidación +2,+4,+6):
- Piro: H2A2
- Orto: H4A
Casos especiales
Dan tres tipos de oxácidos:
· Anhídrido + H2O → Ácido meta-(anhídrido)
· Anhídrido + 2 H2O → Ácido piro-(anhídrido)
· Anhídrido + 3 H2O → Ácido orto-(anhídrido) .
TRABAJADO POR : MARIA ALEJANDRO POMACAJA
Clasificación
Nota: La nomenclatura usada en este artículo para nombrar los compuestos ha sido la tradicional. Los oxácidos son ácidos formados por hidrógeno (H), un elemento no-metálico (X) y oxígeno (O). Dependiendo del número de oxidación, un óxido covalente con agua forma un ácido u otro. Por ejemplo, el óxido nitroso (N2O5) formará el ácido nítrico (HNO3) cuando se combina con agua: N2O5 + H2O → H2N2O6 → 2HNO3 Cada ácido, al perder su(s) hidrógeno(s) produce su(s) respectivo(s) anión(es) con tantas cargas negativas como hidrógenos haya perdido. Dependiendo del número de H que tengan se dividen en 4 grupos. A continuación se han clasificado los ácidos dependiendo del número de H y ejemplos:
Los tres últimos deben llevar el prefijo meta-.
ÁCIDO | ANIÓN | ||
HXO | Ácido (meta)hipo...oso | XO- | (Meta)Hipo...ito |
HXO | Ácido (meta)hipo...oso | XO- | (Meta)Hipo...ito. |
HXO2 | Ácido (meta)...oso | XO2- | (Meta)...ito. |
HXO3 | Ácido (meta)...ico | XO3- | (Meta)...ato. |
HXO4 | Ácido (meta)per....ico | XO4- | (Meta)Per....ato. |
Ejemplos concretos | |||
HIO | IO- | ||
HNO2 | NO2- | ||
HPO3 | PO3- | ||
HBrO4 | BrO4- | ||
ÁCIDO | ANIÓN | ||
H2XO2 | Ácido hipo...oso | XO22- | Hipo...ito |
H2XO3 | Ácido ...oso | XO32- | ...ito |
H2XO4 | Ácido ...ico | XO42- | ...ato |
Ejemplos concretos | |||
H2SO2 | SO22- | ||
H2SeO3 | SeO32- | ||
H2SO4 | SO42- | ||
H2TeO4 | TeO42- | ||
También se pueden nombrar con el prefijo orto-.
ÁCIDO | ANIÓN | ||
H3XO2 | Ácido (orto)hipo...oso | XO23- | (Orto)Hipo...ito |
H3XO3 | Ácido (orto)...oso | XO33- | (Orto)...ito |
H3XO4 | Ácido (orto)...ico | XO43- | (Orto)...ato |
Ejemplos concretos | |||
H3SbO2 | SbO23- | ||
H3AsO3 | AsO33- | ||
H3PO4 | PO43- | ||
Deben llevar el prefijo piro- o di-.
ÁCIDO | ANIÓN | ||
H4X2O3 | Ácido dihipo...oso o pirohipo...oso | X2O34- | Dihipo...ito o pirohipo...ito |
H4X2O5 | Ácido di...oso o piro...oso | X2O54- | Di...ito o piro...ito |
H4X2O7 | Ácido di...ico o piro...ico | X2O74- | Di...ato o piro...ato |
Ejemplos concretos | |||
H4Sb2O3 | Sb2O34- | ||
H4As2O5 | As2O54- | ||
H4P2O7 | P2O74- | ||
Además, según la nomenclatura tradicional, los números de oxidación, la estructura de los compuestos y demás factores, hay ácidos más especiales como el tiociánico (HSCN) que aparentemente no se parecen a los citados anteriormente:
Con Boro
ÁCIDO | ANIÓN | ||
HBO2 | BO2- | ||
H3BO3 | BO33- | ||
Con Silicio
ÁCIDO | ANIÓN | ||
H2SiO3 | SiO32- | ||
H4SiO4 | SiO44- | ||
Con Azufre
ÁCIDO | ANIÓN | ||
H2S2O7 | S2O72- | ||
H2S2O8 | S2O82- | ||
H2SO5 | SO52- | ||
H2S2O3 | S2O32- | ||
Con Carbono
ÁCIDO | ANIÓN | ||
H2CO2 | CO32- | ||
H2CO3 | CO32- | ||
Con Manganeso
ÁCIDO | ANIÓN | ||
H2MnO4 | MnO42- | ||
HMnO4 | MnO4- | ||
Con Cromo
ÁCIDO | ANIÓN | ||
H2CrO4 | CrO42- | ||
H2Cr2O7 | Cr2O72- | ||
ÁCIDO | ANIÓN | ||
HOCN | OCN- | ||
HSCN | SCN- | ||
Otros
Otro importante es el Ácido acético o etanoico CH3-COOH (C2H4O2), con el acetato o etanoato CH3-COO- ([C2H3O2]−)
Como ya hemos visto, los oxácidos tienen aniones que se forman al perder todos los hidrógenos que tenían pero también pueden perder sólo 2 ó sólo 3. Por ejemplo el ácido sulfúrico (H2SO4) puede perder los 2 ó sólo 1 hidrógeno, si pierde los 2 el anión se llamará sulfato (SO42-) pero si sólo pierde 1 se llamará hidrogenosulfato (HSO4-) que es un anión ácido y tiene carga. El Ácido difosfórico (H4P2O7) puede perder los 4: difosfato (P2O74-), 3: hidrogenodifosfato (HP2O73-), 2: dihidrogenodifosfato (H2P2O72-), 1: trihidrogenodifosfato (H3P2O7-). Del Ácido carbónico se puede formar un anión ácido: el hidrogenocarbonato (HCO3-) aunque la IUPAC también acepta el término bicarbonato.
Sales ternarias
Las sales ternarias no son más que la combinación de un anión o anión ácido con otro elemento. Ejemplos:
- Ca(IO)2 - Hipoyodito de calcio
- Ca(HCO3)2 - Hidrogenocarbonato o bicarbonato de calcio
- AlSbO3 - Antimonito u Ortoantimonito de aluminio
- Pb(H2As2O7)2 - Dihidrogenopiroarseniato o Dihidrogenodiarseniato de plomo (IV)
- CaS2O3 - Tiosulfato de calcio
- CsH3SiO4 - Trihidrogenoortosilicato de cesio
- ZnSiO3 - Silicato o Metasilicato de zinc
- Rb3PO2 - Hipofosfito de rubidio
- Na4As2O3 Dihipoarsenito de sodio
- NiSeO3 - Selenito de níquel (II)
Iones poliatómicos especiales de uso frecuente
ÁCIDO | ANIÓN | ||
NH4+ | CN- | ||
Hg22+ | OCN- | ||
O22- | SCN- | ||
S22- | MnO42- | ||
S32- | MnO4- | ||
Sn2- | CrO42- | ||
C22- | Cr2O72- | ||
OH- | CH3-COO- | ||
Química orgánica
La Química Orgánica o Química del carbono es la rama de la química que estudia una clase numerosa de moléculas que contienen carbono formando enlaces covalentes carbono-carbono o carbono-hidrógeno, también conocidos como compuestos orgánicos. Friedrich Wöhler y Archibald Scott Couper son conocidos como los "padres" de la química orgánica.
Cronología
La tarea de presentar la química orgánica de manera sistemática y global se realizó mediante una publicación surgida en Alemania, fundada por el químico Friedrich Konrad Beilstein (1838-1906). Su Handbuch der organischen Chemie (Manual de la química orgánica) comenzó a publicarse en Hamburgo en 1880 y consistió en dos volúmenes que recogían información de unos quince mil compuestos orgánicos conocidos. Cuando la Deutsche chemische Gesellschaft (Sociedad Alemana de Química) trató de elaborar la cuarta re-edición, en la segunda década del siglo XX, la cifra de compuestos orgánicos se había multiplicado por diez. Treinta y siete volúmenes fueron necesarios para la edición básica, que aparecieron entre 1916 y 1937. Un suplemento de 27 volúmenes se publicó en 1938, recogiendo información aparecida entre 1910 y 1919. En la actualidad, se está editando el Fünftes Ergänzungswerk (quinta serie complementaria), que recoge la documentación publicada entre 1960 y 1979. Para ofrecer con más prontitud sus últimos trabajos, el Beilstein Institut ha creado el servicio Beilstein Online, que funciona desde 1988. Recientemente, se ha comenzado a editar periódicamente un CD-ROM, Beilstein Current Facts in Chemistry, que selecciona la información química procedente de importantes revistas. Actualmente, la citada información está disponible a través de internet.La química del carbono
La gran cantidad de compuestos orgánicos que existen tiene su explicación en las características del átomo de carbono, que tiene cuatro electrones en su capa de valencia: según la regla del octeto necesita ocho para completarla, por lo que forma cuatro enlaces (valencia = 4) con otros átomos. Esta especial configuración electrónica da lugar a una variedad de posibilidades de hibridación orbital del átomo de Carbono (hibridación química).Véase también: Hibridación (química)
Véase también: Estructura de Lewis
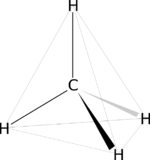
La molécula orgánica más sencilla que existe es el Metano. En esta molécula, el Carbono presenta hibridación sp3, con los átomos de hidrógeno formando un tetraedro.Hidrocarburos El compuesto más simple es el metano, un átomo de carbono con cuatro de hidrógeno (valencia = 1), pero también puede darse la unión carbono-carbono, formando cadenas de distintos tipos, ya que pueden darse enlaces simples, dobles o triples. Cuando el resto de enlaces de estas cadenas son con hidrógeno, se habla de hidrocarburos, que pueden ser:
- saturados: con enlaces covalentes simples, alcanos.
- insaturados, con dobles enlaces covalentes (alquenos) o triples (alquinos).
- aromáticos: estructura cíclica.
Radicales
Los radicales son fragmentos de cadenas de carbonos que cuelgan de la cadena principal. Su nomenclatura se hace con la raíz correspondiente (en el caso de un carbono met-, dos carbonos et-...) y el sufijo -il. Además, se indica con un número, colocado delante, la posición que ocupan. El compuesto más simple que se puede hacer con radicales es el 2-metilpropano. En caso de que haya más de un radical, se nombrarán por orden alfabético de las raíces. Por ejemplo, el 2-etil, 5-metil, 8-butil, 10-docoseno.Isómeros
Ya que el carbono puede enlazarse de diferentes maneras, una cadena puede tener diferentes configuraciones de enlace dando lugar a los llamados isómeros, moléculas con la misma fórmula química pero con distintas estructuras y propiedades.Grupos funcionales
Los compuestos orgánicos también pueden contener otros elementos, también grupos de átomos, llamados grupos funcionales. Un ejemplo es el grupo hidroxilo, que forma los alcoholes: un átomo de oxígeno enlazado a uno de hidrógeno (-OH), al que le queda una valencia libre.Oxigenados
Son cadenas de carbonos con uno o varios átomos de oxígeno. Pueden ser:Compuestos orgánicos
Los compuestos estudiados pueden dividirse en :- compuestos alifáticos
- compuestos aromáticos
- compuestos heterocíclicos
- compuestos organometálicos
- polímeros
trabajado por maria flores lobaton